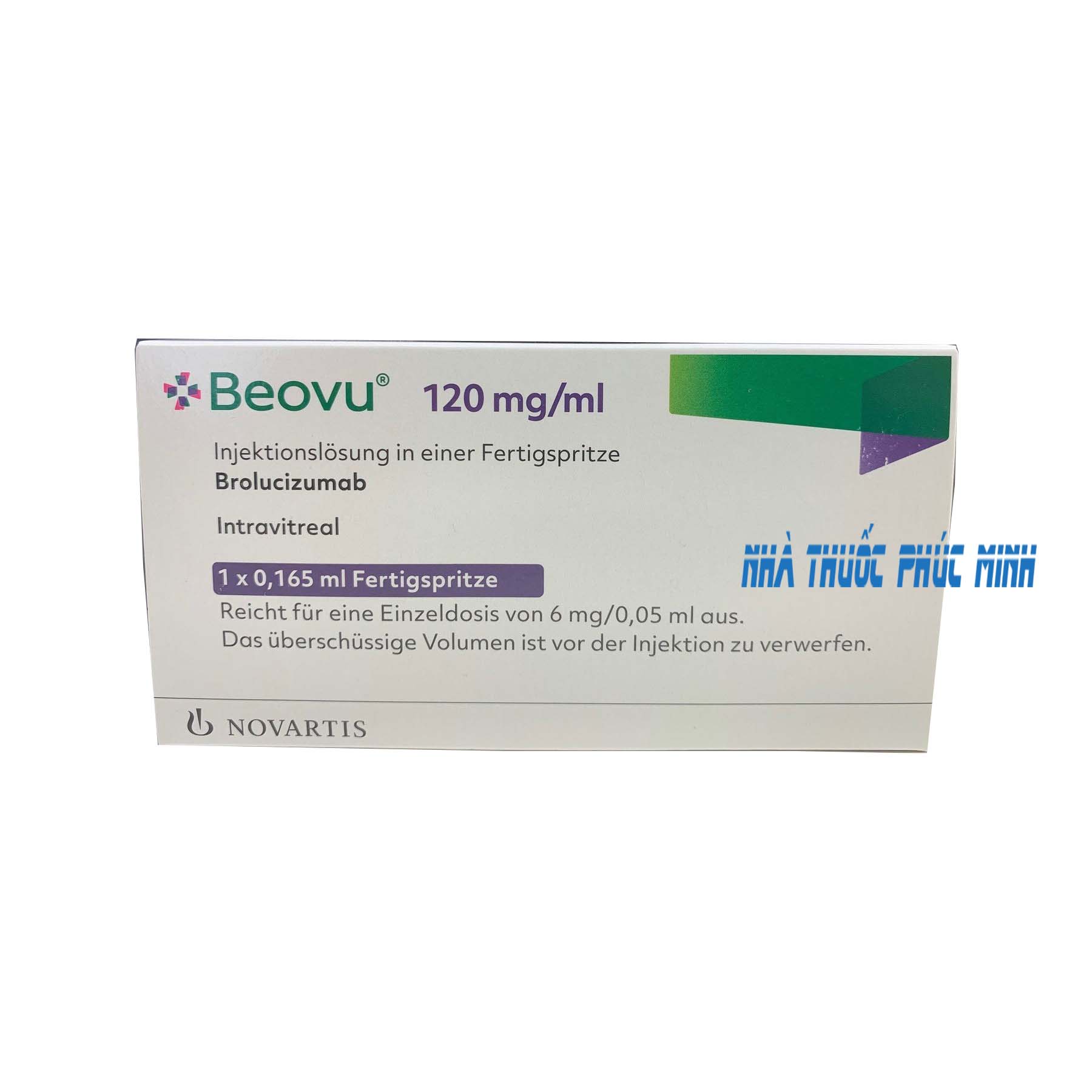
Thuốc Beovu 120mg/ml điều trị thoái hóa điểm vàng
0₫
Thuốc Beovu 120mg/ml Brolucizumab giá bao nhiêu? Thuốc Beovu điều trị thoái hóa điểm vàng? mua thuốc ở đâu uy tín? liều dùng cách dùng? tác dụng phụ thuốc? thời gian dùng?
Liên hệ 0969870429 để được tư vấn.
Beovu là thuốc gì? Thuốc có công dụng như thế nào? Liều dùng và cách dùng thuốc ra sao? Hãy cùng tham khảo bài viết.
Beovu là thuốc gì?
Brolucizumab là chất ức chế yếu tố tăng trưởng nội mô mạch máu (VEGF) có tác dụng làm giảm sự tăng sinh của tế bào nội mô, sự tạo mạch của mô và tính thấm của mạch máu. Thuốc này có thời gian tác dụng dài vì được dùng hàng tháng. Bệnh nhân nên được tư vấn về nguy cơ viêm nội nhãn, bong võng mạc và biến cố huyết khối động mạch sau khi dùng thuốc này.
Brolucizumab đã được FDA phê duyệt vào tháng 10 năm 2019 để điều trị thoái hóa điểm vàng liên quan đến tuổi tân mạch.
Beovu là thuốc kê toa dạng tiêm truyền, chứa hoạt chất Brolucizumab. Thành phần trong thuốc bao gồm:
Hoạt chất: Brolucizumab 120mg/ml.
Đóng gói: Mỗi ống tiêm đóng sẵn chứa 19,8 mg brolucizumab trong dung dịch 0,165 ml. Điều này cung cấp một lượng có thể sử dụng để cung cấp một liều duy nhất dung dịch 0,05 ml chứa 6 mg brolucizumab.
Xuất xứ: Novartis.
Công dụng của thuốc Beovu
Beovu được chỉ định ở người lớn để điều trị
• Thoái hóa điểm vàng liên quan đến tuổi tác (ướt) tân mạch (AMD),
• suy giảm thị lực do phù hoàng điểm do tiểu đường (DME).
Cơ chế tác dụng thuốc
Brolucizumab là mảnh kháng thể Fv (scFv) chuỗi đơn đơn dòng được nhân bản hóa với trọng lượng phân tử ~ 26 kDa.
Mức độ tín hiệu tăng lên thông qua con đường yếu tố tăng trưởng nội mô mạch máu A (VEGF-A) có liên quan đến sự hình thành mạch máu mắt bệnh lý và phù võng mạc. Brolucizumab liên kết với ái lực cao với các đồng phân VEGF-A (ví dụ VEGF110, VEGF121 và VEGF165), do đó ngăn chặn sự liên kết của VEGF-A với các thụ thể VEGFR-1 và VEGFR-2 của nó. Bằng cách ức chế liên kết VEGF-A, brolucizumab ngăn chặn sự tăng sinh tế bào nội mô, do đó làm giảm quá trình tân mạch bệnh lý và giảm tính thấm của mạch máu.
Liều dùng, cách sử dụng thuốc
Beovu phải được thực hiện bởi bác sĩ nhãn khoa có trình độ chuyên môn, có kinh nghiệm về tiêm nội nhãn.
Liều lượng
AMD ướt
Bắt đầu điều trị – tải
Liều khuyến cáo là 6 mg brolucizumab (dung dịch 0,05 ml) tiêm trong dịch kính 4 tuần một lần (hàng tháng) trong 3 liều đầu tiên. Đánh giá hoạt động của bệnh được đề xuất 16 tuần (4 tháng) sau khi bắt đầu điều trị.
Ngoài ra, có thể dùng 6 mg brolucizumab (dung dịch 0,05 ml) 6 tuần một lần cho 2 liều đầu tiên. Đánh giá mức độ hoạt động của bệnh được đề xuất 12 tuần (3 tháng) sau khi bắt đầu điều trị. Liều thứ ba có thể được tiêm dựa trên hoạt động của bệnh được đánh giá bằng thị lực và/hoặc các thông số giải phẫu ở tuần thứ 12.
Điều trị duy trì
Sau liều nạp cuối cùng, bác sĩ có thể cá nhân hóa khoảng thời gian điều trị dựa trên hoạt động của bệnh được đánh giá bằng thị lực và/hoặc các thông số giải phẫu. Ở những bệnh nhân không có hoạt động bệnh, nên cân nhắc điều trị 12 tuần một lần (3 tháng). Ở những bệnh nhân có bệnh đang hoạt động, nên cân nhắc điều trị 8 tuần (2 tháng) một lần.
Nếu kết quả thị giác và giải phẫu cho thấy bệnh nhân không được hưởng lợi từ việc tiếp tục điều trị, nên ngừng sử dụng Beovu.
DME
Liều khuyến cáo là 6 mg brolucizumab (dung dịch 0,05 ml) tiêm tĩnh mạch mỗi 6 tuần trong 5 liều đầu tiên. Sau đó, bác sĩ có thể cá nhân hóa khoảng thời gian điều trị dựa trên hoạt động của bệnh được đánh giá bằng thị lực và/hoặc các thông số giải phẫu. Ở những bệnh nhân không có hoạt động bệnh, nên cân nhắc điều trị 12 tuần một lần (3 tháng). Ở những bệnh nhân có bệnh đang hoạt động, nên cân nhắc điều trị 8 tuần một lần (2 tháng). Sau 12 tháng điều trị, ở những bệnh nhân không có hoạt động bệnh, có thể cân nhắc khoảng thời gian điều trị lên tới 16 tuần (4 tháng).
Nếu kết quả thị giác và giải phẫu cho thấy bệnh nhân không được hưởng lợi từ việc tiếp tục điều trị, nên ngừng sử dụng Beovu.
Cách dùng thuốc
Beovu chỉ dành cho sử dụng trong dịch kính.
Dung dịch tiêm phải được kiểm tra bằng mắt trước khi dùng.
Quy trình tiêm trong dịch kính phải được thực hiện trong điều kiện vô trùng, bao gồm việc sử dụng chất khử trùng tay khi phẫu thuật, găng tay vô trùng, tấm phủ vô trùng và mỏ vịt mí mắt vô trùng (hoặc tương đương). Nên có sẵn dụng cụ chọc dịch vô trùng như một biện pháp phòng ngừa. Cần đánh giá cẩn thận bệnh sử về phản ứng quá mẫn của bệnh nhân trước khi thực hiện thủ thuật tiêm nội nhãn. Nên gây mê đầy đủ và dùng thuốc diệt vi khuẩn tại chỗ phổ rộng để khử trùng da quanh mắt, mí mắt và bề mặt mắt trước khi tiêm.
Kim tiêm nên được đưa vào phía sau rìa 3,5 đến 4,0 mm vào khoang thủy tinh thể, tránh kinh tuyến ngang và hướng về phía trung tâm nhãn cầu. Thể tích tiêm 0,05 ml sau đó được truyền chậm; nên sử dụng vị trí củng mạc khác cho những lần tiêm tiếp theo.
Ngay sau khi tiêm nội nhãn, bệnh nhân cần được theo dõi tình trạng tăng áp lực nội nhãn. Việc theo dõi thích hợp có thể bao gồm kiểm tra tưới máu đầu dây thần kinh thị giác hoặc đo nhãn áp. Nếu cần thiết, nên có sẵn thiết bị vô trùng để chọc hút.
Sau khi tiêm nội nhãn, bệnh nhân nên được hướng dẫn báo cáo bất kỳ triệu chứng nào gợi ý viêm nội nhãn (ví dụ: đau mắt, đỏ mắt, sợ ánh sáng, mờ thị lực) ngay lập tức.
Bơm tiêm
Ống tiêm đóng sẵn chỉ dành cho sử dụng một lần. Mỗi ống tiêm đóng sẵn chỉ nên được sử dụng để điều trị một mắt.
Vì thể tích chứa trong ống tiêm đóng sẵn (0,165 ml) lớn hơn liều khuyến cáo (0,05 ml), nên một phần thể tích chứa trong ống tiêm đóng sẵn phải được loại bỏ trước khi dùng.
Tiêm toàn bộ thể tích của ống tiêm chứa đầy thuốc có thể dẫn đến quá liều. Để loại bỏ bọt khí cùng với lượng thuốc dư thừa, phải ấn pít tông từ từ cho đến khi cạnh bên dưới vòm của nút cao su thẳng hàng với vạch liều 0,05 ml (tương đương với 50 µl, tức là 6 mg brolucizumab).
Chống chỉ định
- Quá mẫn cảm với hoạt chất hoặc với bất kỳ tá dược nào của thuốc.
- Bệnh nhân bị nhiễm trùng mắt hoặc quanh mắt đang hoạt động hoặc nghi ngờ.
- Bệnh nhân bị viêm nội nhãn hoạt động.
Cần lưu ý gì khi dùng thuốc Beovu
Cảnh báo và thận trọng thuốc
Viêm nội nhãn, viêm nội nhãn, đục thủy tinh thể do chấn thương, bong võng mạc, rách võng mạc, viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc
Tiêm nội nhãn, kể cả tiêm Beovu, có liên quan đến viêm nội nhãn, viêm nội nhãn, đục thủy tinh thể do chấn thương, bong võng mạc và rách võng mạc. Phải luôn sử dụng kỹ thuật tiêm vô trùng thích hợp khi sử dụng Beovu.
Bệnh nhân nên được hướng dẫn báo cáo bất kỳ triệu chứng nào gợi ý đến các sự kiện nêu trên ngay lập tức.
Viêm nội nhãn, bao gồm viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc
Viêm nội nhãn, bao gồm viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc, đã được báo cáo khi sử dụng Beovu. Số lượng các biến cố viêm nội nhãn cao hơn đã được quan sát thấy ở những bệnh nhân có kháng thể xuất hiện sau điều trị. Sau khi điều tra, người ta phát hiện viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc là các hiện tượng qua trung gian miễn dịch. Viêm nội nhãn, bao gồm viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc, có thể xảy ra sau lần tiêm nội nhãn đầu tiên và tại bất kỳ thời điểm điều trị nào. Những sự kiện này được quan sát thường xuyên hơn khi bắt đầu điều trị.
Dựa trên các nghiên cứu lâm sàng, những biến cố này xảy ra thường xuyên hơn ở bệnh nhân nữ được điều trị bằng Beovu so với bệnh nhân nam (ví dụ: 5,3% nữ so với 3,2% nam ở HAWK và HARRIER) và ở bệnh nhân Nhật Bản.
Ở những bệnh nhân phát triển các biến cố này, nên ngừng điều trị bằng Beovu và xử lý kịp thời các biến cố này. Những bệnh nhân được điều trị bằng Beovu có tiền sử viêm nội nhãn và/hoặc tắc mạch máu võng mạc (trong vòng 12 tháng trước lần tiêm brolucizumab đầu tiên) nên được theo dõi chặt chẽ, vì họ có nguy cơ cao bị viêm mạch máu võng mạc và/hoặc tắc mạch máu võng mạc.
Khoảng cách giữa hai liều Beovu trong quá trình điều trị duy trì không được ít hơn 8 tuần vì tỷ lệ viêm nội nhãn cao hơn (bao gồm viêm mạch máu võng mạc) và tắc mạch máu võng mạc đã được báo cáo ở những bệnh nhân mắc bệnh nAMD dùng Beovu với liều duy trì 4 tuần một lần trong một thử nghiệm lâm sàng. nghiên cứu so sánh với những bệnh nhân dùng Beovu với liều duy trì 8 hoặc 12 tuần một lần trong các nghiên cứu lâm sàng giai đoạn III quan trọng.
Áp lực nội nhãn tăng
Đã thấy tăng áp lực nội nhãn thoáng qua trong vòng 30 phút sau khi tiêm thuốc ức chế yếu tố tăng trưởng nội mô mạch máu (VEGF), bao gồm cả brolucizumab. Cần có biện pháp phòng ngừa đặc biệt ở những bệnh nhân mắc bệnh tăng nhãn áp được kiểm soát kém (không tiêm Beovu khi áp lực nội nhãn ≥30 mmHg). Cả áp lực nội nhãn và tưới máu của đầu dây thần kinh thị giác phải được theo dõi và quản lý thích hợp.
Đối xử song phương
Tính an toàn và hiệu quả của brolucizumab dùng đồng thời ở cả hai mắt chưa được nghiên cứu.
Tính sinh miễn dịch
Vì đây là protein trị liệu nên brolucizumab có khả năng gây miễn dịch. Bệnh nhân nên được hướng dẫn thông báo cho bác sĩ nếu họ xuất hiện các triệu chứng như đau mắt hoặc tăng khó chịu, đỏ mắt trầm trọng hơn, mờ hoặc giảm thị lực, tăng số lượng các hạt nhỏ trong tầm nhìn hoặc tăng độ nhạy cảm với ánh sáng.
Sử dụng đồng thời với thuốc kháng VEGF khác
Không có dữ liệu về việc sử dụng đồng thời Beovu với các sản phẩm thuốc kháng VEGF khác trên cùng một mắt. Brolucizumab không nên được dùng đồng thời với các sản phẩm thuốc kháng VEGF khác (toàn thân hoặc mắt).
Từ chối điều trị
Trong phương pháp điều trị bằng thuốc kháng VEGF tiêm tĩnh mạch, nên ngừng liều và không nên tiếp tục điều trị sớm hơn lần điều trị theo lịch trình tiếp theo trong trường hợp:
• giảm thị lực được điều chỉnh tốt nhất (BCVA) ≥30 chữ cái so với lần đánh giá thị lực gần đây nhất;
• vỡ võng mạc;
• xuất huyết dưới võng mạc liên quan đến trung tâm của hố mắt, hoặc, nếu kích thước xuất huyết ≥50% tổng diện tích tổn thương;
• đã thực hiện hoặc lên kế hoạch phẫu thuật nội nhãn trong vòng 28 ngày trước đó hoặc tiếp theo.
Rách biểu mô sắc tố võng mạc
Các yếu tố nguy cơ liên quan đến sự phát triển của vết rách biểu mô sắc tố võng mạc sau khi điều trị bằng thuốc kháng VEGF đối với bệnh AMD thể ướt bao gồm bong võng mạc biểu mô sắc tố lớn và/hoặc cao. Khi bắt đầu điều trị bằng brolucizumab, nên thận trọng ở những bệnh nhân có các yếu tố nguy cơ bị rách biểu mô sắc tố võng mạc.
Bong võng mạc hoặc lỗ hoàng điểm
Nên ngừng điều trị ở những bệnh nhân bị bong võng mạc do hình thoi hoặc có lỗ hoàng điểm giai đoạn 3 hoặc 4.
Tác dụng toàn thân sau khi sử dụng thuốc nội nhãn
Các tác dụng phụ toàn thân, bao gồm xuất huyết ngoài mắt và huyết khối động mạch, đã được báo cáo sau khi tiêm thuốc ức chế VEGF vào dịch kính và có nguy cơ về mặt lý thuyết rằng những tác dụng này có thể liên quan đến ức chế VEGF. Có rất ít dữ liệu về tính an toàn trong điều trị bệnh nhân AMD và DME có tiền sử đột quỵ, cơn thiếu máu cục bộ thoáng qua hoặc nhồi máu cơ tim trong vòng 3 tháng qua. Cần thận trọng khi điều trị cho những bệnh nhân như vậy.
Tương tác thuốc
Không có nghiên cứu tương tác đã được thực hiện.
Dùng thuốc cho phụ nữ mang thai và cho con bú
Thai kỳ
Không có hoặc có rất ít dữ liệu về việc sử dụng brolucizumab ở phụ nữ mang thai. Một nghiên cứu trên khỉ cynomolgus đang mang thai không cho thấy bất kỳ tác hại nào liên quan đến độc tính sinh sản. Các nghiên cứu trên động vật chưa đầy đủ về độc tính sinh sản. Mặc dù mức phơi nhiễm toàn thân sau khi nhỏ mắt là rất thấp do cơ chế tác dụng của nó nhưng vẫn có nguy cơ tiềm ẩn đối với sự phát triển của phôi thai. Do đó, không nên sử dụng brolucizumab trong thời kỳ mang thai trừ khi lợi ích tiềm tàng vượt trội hơn nguy cơ tiềm ẩn đối với thai nhi.
Cho con bú
Không rõ liệu brolucizumab có được bài tiết qua sữa mẹ hay không. Trong một nghiên cứu về độc tính sinh sản, brolucizumab không được phát hiện trong sữa mẹ hoặc huyết thanh trẻ sơ sinh của khỉ cynomolgus. Không thể loại trừ nguy cơ đối với trẻ sơ sinh/trẻ sơ sinh bú sữa mẹ. Brolucizumab không được khuyến cáo trong thời gian cho con bú và không nên bắt đầu cho con bú ít nhất một tháng sau liều cuối cùng khi ngừng điều trị bằng brolucizumab. Phải đưa ra quyết định ngừng cho con bú hay kiêng điều trị bằng brolucizumab, có tính đến lợi ích của việc cho con bú sữa mẹ đối với trẻ và lợi ích của việc điều trị đối với người phụ nữ.
Khả năng sinh sản
Không có nghiên cứu về sinh sản hoặc khả năng sinh sản đã được tiến hành. Sự ức chế VEGF đã được chứng minh là ảnh hưởng đến sự phát triển nang trứng, chức năng hoàng thể và khả năng sinh sản. Dựa trên cơ chế hoạt động của chất ức chế VEGF, có nguy cơ tiềm ẩn đối với khả năng sinh sản của phụ nữ.
Ảnh hưởng thuốc lên lái xe và vận hành máy móc
Beovu có ảnh hưởng nhỏ đến khả năng lái xe và vận hành máy móc do có thể xảy ra rối loạn thị giác tạm thời sau khi tiêm thuốc nội hấp và khám mắt liên quan. Bệnh nhân không nên lái xe hoặc sử dụng máy móc cho đến khi chức năng thị giác hồi phục đầy đủ.
Hiệu quả lâm sàng của Beovu
AMD ướt
Beovu đã được điều tra trong hai nghiên cứu chính kéo dài khoảng 2 năm với tổng số khoảng 1.800 bệnh nhân mắc bệnh AMD thể ướt. Các nghiên cứu đã so sánh Beovu (được tiêm mỗi tháng một lần trong 3 tháng, sau đó là 8 hoặc 12 tuần một lần) với aflibercept (một phương pháp điều trị khác dành cho AMD) được tiêm mỗi tháng một lần trong 3 tháng, sau đó là 8 tuần một lần. Thước đo chính về hiệu quả là sự thay đổi thị lực của bệnh nhân sau năm điều trị đầu tiên, được đo bằng số chữ cái mà họ có thể nhận ra trong bài kiểm tra mắt tiêu chuẩn. Cả hai nghiên cứu cũng xem xét việc duy trì hiệu quả trong năm điều trị thứ hai.
Beovu đã được chứng minh là có hiệu quả tương đương với aflibercept trong việc duy trì thị lực ở bệnh nhân mắc bệnh AMD thể ướt. Trong nghiên cứu đầu tiên, thị lực của bệnh nhân được cải thiện trung bình 6,4 chữ cái ở bệnh nhân được điều trị bằng Beovu và 7 chữ cái ở bệnh nhân dùng aflibercept. Trong nghiên cứu thứ hai, sự cải thiện là 6,9 chữ cái đối với bệnh nhân dùng Beovu và 7,6 chữ cái đối với bệnh nhân dùng aflibercept. Trong năm điều trị thứ hai, hiệu quả của Beovu nhìn chung được duy trì.
DME
Beovu đã được chứng minh là có hiệu quả trong điều trị giảm thị lực do DME trong hai nghiên cứu chính với tổng số 926 bệnh nhân. Các nghiên cứu này so sánh Beovu được tiêm 6 tuần một lần trong 5 liều đầu tiên và sau đó cứ 8 hoặc 12 tuần một lần với aflibercept (một phương pháp điều trị khác cho DME) được tiêm mỗi tháng một lần trong 5 tháng và sau đó là 8 tuần một lần. Thước đo chính về hiệu quả là sự thay đổi thị lực của bệnh nhân sau năm điều trị đầu tiên, được đo bằng số chữ cái mà họ có thể nhận ra trong bài kiểm tra mắt tiêu chuẩn.
Trong cả hai nghiên cứu, Beovu đều có hiệu quả tương đương với aflibercept trong việc cải thiện thị lực ở bệnh nhân sau một năm điều trị. Trong nghiên cứu đầu tiên, bệnh nhân được điều trị bằng Beovu đã cải thiện điểm kiểm tra trung bình là 9,2 chữ cái, so với 10,5 chữ cái ở bệnh nhân dùng aflibercept. Trong nghiên cứu thứ hai, sự cải thiện là 10,6 chữ cái đối với bệnh nhân được điều trị bằng Beovu và 9,4 chữ cái đối với bệnh nhân được điều trị bằng aflibercept.
Tác dụng phụ khi dùng thuốc Beovu
AMD ướt
Đối với AMD thể ướt, tổng cộng 1.088 bệnh nhân được điều trị bằng brolucizumab tạo thành quần thể an toàn trong hai nghiên cứu Pha III. Trong số này, 730 bệnh nhân được điều trị với liều khuyến cáo là 6 mg.
Các phản ứng bất lợi được báo cáo thường xuyên nhất là giảm thị lực (7,3%), đục thủy tinh thể (7,0%), xuất huyết kết mạc (6,3%) và nổi thủy tinh thể (5,1%).
Các phản ứng bất lợi nghiêm trọng nhất là mù lòa (0,8%), viêm nội nhãn (0,7%), tắc động mạch võng mạc (0,8%) và bong võng mạc (0,7%).
DME
Đối với DME, tổng số 558 bệnh nhân được điều trị bằng brolucizumab là quần thể an toàn trong hai nghiên cứu Pha III. Trong số này, 368 bệnh nhân được điều trị với liều khuyến cáo là 6 mg.
Các phản ứng bất lợi được báo cáo thường xuyên nhất là đục thủy tinh thể (9,0%), xuất huyết kết mạc (6,5%) và tăng áp lực nội nhãn (5,4%).
Các phản ứng bất lợi nghiêm trọng nhất là đục thủy tinh thể (9,0%), tắc mạch máu võng mạc (1,1%), tắc động mạch võng mạc (0,8%) và viêm nội nhãn (0,5%).
Thuốc Beovu mua ở đâu giá bao nhiêu?
Beovu 120mg/ml hiện chưa được phân phối chính hãng tại Việt Nam. Liên hệ 0969870429 để được tư vấn.
Tài liệu tham khảo:
Sản phẩm tương tự
THUỐC ĐẶC TRỊ